Las enzimas son esenciales para el correcto funcionamiento de todos los organismos vivos de la Tierra. Participan en la mayoría, si no en todas, las transformaciones químicas de la naturaleza, es decir, en millones de reacciones tanto en el mundo vegetal como en el animal. Vale la pena averiguar qué son las enzimas, cómo funcionan y cuál es su importancia para la medicina moderna.
Tabla de contenido
- Enzimas: Estructura
- Regulación de la actividad enzimática
- Enzimas: papel
- Enzimas: Nomenclatura
- Enzimas y medicina
- Enfermedades resultantes de enzimas disfuncionales.
- Enzimas: uso en diagnóstico.
- Enzimas y tratamiento
Las enzimas son moléculas de proteínas que aceleran o incluso permiten que se produzcan diversas reacciones químicas en los organismos vivos, incluido el cuerpo humano.
Desde un punto de vista químico, estos son catalizadores, es decir, partículas que intensifican la reacción, pero que no se desgastan durante la reacción. Este aumento en la eficiencia de las transformaciones químicas suele ser enorme, los catalizadores naturales pueden acortar el tiempo de reacción de varios años a varios segundos.
Las enzimas se encuentran en todas las áreas del cuerpo: en las células, en el espacio extracelular, en los tejidos, en los órganos y en su luz, los catalizadores que produce un tejido determinado determinan sus propiedades específicas y el papel que desempeña en el cuerpo.
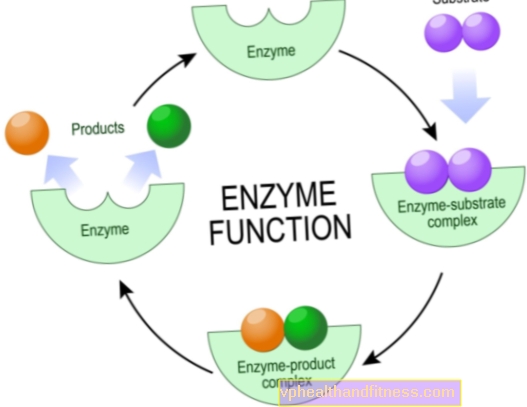
La mayoría de las enzimas son muy específicas, lo que significa que cada una de ellas es responsable de un solo tipo de reacción química en la que participan partículas específicas, los sustratos, y solo ellas pueden interactuar con una enzima determinada.
La actividad de los catalizadores naturales depende de muchos factores: el entorno de reacción, por ejemplo, la temperatura, el pH, la presencia de ciertos iones, los activadores: mejoran la acción de enzimas e inhibidores que contrarrestan esta actividad.
Enzimas: Estructura
Como se mencionó, la mayoría de las enzimas son proteínas, tienen una estructura muy diversa: desde varias docenas de aminoácidos hasta varios miles dispuestos en una estructura espacial diversa.
Es la forma de su formación (la llamada estructura cuaternaria) y el hecho de que la mayoría de las enzimas sean mucho más grandes que los reactivos de sus reacciones es en gran parte responsable de su actividad.
Esto se debe al hecho de que en la estructura de las enzimas solo una determinada región es el llamado sitio activo, es decir, el fragmento responsable de llevar a cabo la reacción.
La tarea de los fragmentos restantes de la molécula es unir un sustrato específico, con menos frecuencia otros compuestos que afectan la actividad de la enzima.
Vale la pena saber que la estructura del catalizador está diseñada de modo que el sustrato de unión se adapte idealmente en términos de una "llave para la cerradura".
Como todas las proteínas, las enzimas se producen en los ribosomas a partir del material genético que está empaquetado de manera compacta en el núcleo, el ADN, creando así la llamada estructura primaria.
Luego se dobla varias veces, cambiando su forma, a veces agregando azúcares, iones metálicos o residuos grasos.
El resultado de todos estos procesos es la formación de una estructura cuaternaria activa, es decir, una forma completamente biológicamente activa.
En muchos casos, varias partículas enzimáticas se combinan para llevar a cabo una serie de reacciones químicas y así acelerar el proceso.
Sucede que en varios tejidos existen enzimas que catalizan la misma reacción, pero no son estructuralmente similares entre sí, las llamamos isoenzimas.
Los nombres de las isoenzimas son los mismos, a pesar de la diferencia de ubicación y estructura, pero estas diferencias tienen una aplicación práctica. Por lo tanto, es posible determinar en pruebas de laboratorio solo aquellas fracciones de enzimas que provienen de un órgano específico.
Los mecanismos de acción de las enzimas son diversos, pero desde un punto de vista químico, su tarea es siempre reducir la energía de activación de la reacción. Esta es la cantidad de energía que deben tener los sustratos para que se lleve a cabo el proceso.
Este efecto se puede lograr creando un ambiente apropiado para llevar a cabo la reacción, usando una ruta química diferente para obtener los mismos productos, o una disposición espacial apropiada de los sustratos.
Cada uno de estos mecanismos puede ser utilizado por enzimas.
Regulación de la actividad enzimática
La acción de las enzimas depende de parámetros ambientales: temperatura, pH y otros. Cada uno de los catalizadores naturales tiene su propio rendimiento óptimo en determinadas condiciones, que pueden ser muy diferentes dependiendo de su tolerancia a las condiciones ambientales.
En el caso de la temperatura, la mayoría de las reacciones enzimáticas se ejecutan más rápido a temperaturas más altas, pero a una cierta temperatura, la eficiencia de la reacción cae rápidamente, lo que es causado por el daño térmico de la enzima (desnaturalización).
En cuanto a su estructura, las hormonas se pueden dividir en dos grupos:
- simple: estas son solo partículas de proteína
- complejo - que requiere la unión de un grupo no proteico - un cofactor para su actividad
Estos últimos juegan un papel clave en la adecuada actividad y regulación de las enzimas.
A su vez, los cofactores se pueden dividir en dos grupos: los necesarios para el funcionamiento de la enzima, fuertemente asociados a ella - estos son los llamados grupos protésicos, pueden ser metales, moléculas orgánicas, como el hemo.
El segundo grupo son las coenzimas, generalmente son responsables de la transferencia de sustratos o electrones, y su unión a la enzima es débil, este grupo incluye, por ejemplo, el ácido fólico, coenzima A. Vale la pena saber que muchas vitaminas actúan como cofactores.
Los inhibidores realizan una tarea completamente diferente, son partículas que inhiben la actividad enzimática al unirse a la enzima.
Existen varios tipos de inhibidores:
- irreversibles: provocan la inactivación permanente de la molécula y la reacción solo puede tener lugar después de la producción de una nueva enzima
- competitivo: en este caso, el inhibidor tiene una estructura similar al sustrato, por lo que compiten por el sitio activo. Si se adhiere un inhibidor, la reacción falla siempre que el sustrato sea normal.
- no competitivo: estos inhibidores se unen a la enzima en un lugar diferente al del sustrato, por lo que puede unirse a la enzima, pero la reacción no tiene lugar
A una concentración mucho más alta del sustrato que el inhibidor, el efecto del inhibidor competitivo se supera porque supera la "competencia" por el sitio activo, en el caso de no competitivo, su efecto no puede superarse aumentando la concentración del sustrato.
Además de la regulación de los sistemas activador e inhibidor, existen muchos otros métodos para controlar la actividad enzimática.
Se refieren al control celular de la producción a nivel de formación de proteínas, así como a la regulación del llamado procesamiento postraduccional, es decir, cambios en la estructura de una molécula de proteína que ocurren inmediatamente después de su síntesis en el ribosoma. Estas modificaciones son, por ejemplo, acortar la cadena polipeptídica.
Los siguientes métodos de regulación se refieren a la segregación y colocación de enzimas en áreas apropiadas: celular y en orgánulos específicos, o en el compartimento extracelular.
Existe otro mecanismo regulador importante, la retroalimentación negativa, que es el sistema de control principal del sistema endocrino. Funciona según el principio de inhibición.
Esto significa que si una enzima produce demasiado de una determinada hormona, se une a ella provocando la inhibición de la actividad y la reducción de la síntesis, por lo que el producto de reacción en sí mismo inhibe su producción.
Enzimas: papel
Cada tejido del cuerpo humano produce un conjunto específico de enzimas, que define el papel de estas células en el funcionamiento del cuerpo. Cuáles son estas enzimas se define por el código genético y qué regiones están activas en una célula determinada.
En el cuerpo humano tienen lugar miles de reacciones químicas en cualquier momento, cada una de las cuales requiere una enzima específica, por lo que sería difícil enumerar todas estas partículas presentes en nuestro cuerpo.
Sin embargo, vale la pena conocer algunos de los más característicos:
- Enzimas digestivas: producidas por los tejidos del sistema digestivo, descomponen los alimentos en compuestos simples, porque solo estos pueden ser absorbidos por la sangre. Son enzimas extracelulares, por lo que cumplen su principal función fuera de las células en las que se producen. Algunas de estas enzimas se forman en forma inactiva, las denominadas proenzimas o zimógenos, y se activan en el tracto gastrointestinal. Las enzimas digestivas incluyen, por ejemplo, amilasa, lipasa, tripsina.
- La miosina es una enzima que se encuentra en los músculos, descompone las moléculas de ATP que son portadoras de energía, gracias a lo cual hace que las fibras musculares se contraigan.
- Las peroxidasas son enzimas oxidantes y catalasas, es decir, enzimas reductoras.
- La acetilcolinesterasa es una enzima que descompone la acetilcolina, uno de los mensajeros del sistema nervioso.
- La monoamino oxidasa es la enzima más abundante en el hígado y es responsable de la descomposición de la adrenalina, la noradrenalina y algunos medicamentos.
- Cytochome oxidase, una enzima intracelular muy importante responsable de los cambios de energía
- Lisozima, una sustancia presente, por ejemplo, en las lágrimas o la saliva que cumple funciones protectoras, destruye los patógenos.
- Alcohol deshidrogenasa, una enzima en el hígado responsable de descomponer el etanol.
- Fosfatasa alcalina, participa en la formación ósea por osteoblastos
Enzimas: Nomenclatura
Los nombres de las enzimas suelen ser bastante complicados ya que se derivan del nombre de la reacción que llevan a cabo y del sustrato involucrado en esa reacción, por ejemplo, 5-hidroxitriptófano descarboxilasa.
Normalmente, el sufijo "-aza" se añade al nombre general de la reacción, y la segunda parte del nombre de la enzima forma el nombre del compuesto que experimenta esta reacción.
Sucede que el nombre es único, luego proviene de un sustrato, por ejemplo, lactasa (enzima que descompone la lactosa).
Más raramente, los nombres de las enzimas derivan de un proceso general que tiene lugar con su participación, por ejemplo, ADN girasa, es decir, la enzima responsable de la rotación de las cadenas de ADN.
Algunas enzimas finalmente tienen nombres comunes, o los que les dio su descubridor, como la pepsina (que descompone las proteínas en el tracto digestivo) o la lisozima (una enzima bactericida contenida en las lágrimas).
También hay un pequeño grupo de enzimas de restricción que se encargan de cortar las hebras de ADN, en este caso el nombre proviene del microorganismo del que se aisló la enzima.
La Unión Internacional de Bioquímica y Biología Molecular introdujo las reglas para nombrar las enzimas y las dividió en varias clases para estandarizar la nomenclatura.
No reemplazó los nombres descritos anteriormente, es más bien un complemento de los utilizados principalmente por científicos.
De acuerdo con las reglas de la Unión Europea, cada enzima se describe mediante una secuencia de caracteres: EC x.xx.xx.xx - donde el primer dígito representa la clase, subclases y subclases posteriores y finalmente el número de enzima. Las clases de enzimas mencionadas son:
• 1 - oxidorreductasas: catalizan reacciones de oxidación y reducción
• 2 - transferasas: transfieren grupos funcionales (por ejemplo, fosfato)
• 3 - hidrolasas: corresponden a la hidrólisis (descomposición) de enlaces
• 4 - liasas: rompen los enlaces en un mecanismo diferente al de la hidrólisis
• 5 - isomerasas: son responsables de los cambios espaciales de las moléculas
• 6 - ligasas: conectan moléculas con enlaces covalentes
Enzimas y medicina
La importancia de las enzimas para la salud humana es enorme. Su correcto funcionamiento permite una vida sana y gracias al desarrollo de dispositivos analíticos hemos aprendido a diagnosticar diversas enfermedades mediante la determinación de enzimas. Además, somos capaces de tratar con éxito las deficiencias de algunas enzimas y las enfermedades resultantes, pero lamentablemente todavía queda mucho por hacer en este sentido.
El tratamiento de las causas de las enfermedades metabólicas aún no es posible, porque no podemos modificar de manera segura y eficaz el material genético para reparar genes dañados y, por lo tanto, enzimas producidas incorrectamente.
Enfermedades resultantes de enzimas disfuncionales.
El buen funcionamiento de nuestro organismo depende en gran medida del buen funcionamiento de las enzimas. En muchos casos, las enfermedades afectan la cantidad de enzimas, provocando su liberación excesiva de las células o, por el contrario, deficientes.Los siguientes son solo ejemplos de enfermedades causadas por funciones enzimáticas anormales, hay muchas más.
- Bloqueos metabólicos o enfermedades metabólicas
Los bloqueos metabólicos o enfermedades metabólicas son un grupo de enfermedades hereditarias provocadas por la acumulación de sustancias en la célula debido a la falta de una enzima responsable de su metabolismo. Los sustratos acumulados con el tiempo son tantos que se vuelven tóxicos para las células y para todo el organismo.
Estas enfermedades son varios miles, su número refleja la multitud de enzimas que se encuentran en el cuerpo humano, porque las enfermedades metabólicas pueden afectar a la mayoría de los genes que codifican las enzimas.
Algunos ejemplos son la galactosemia u homocistinuria, que son enfermedades raras que se manifiestan con mayor frecuencia inmediatamente después del nacimiento o en los primeros años de vida.
- Tumores
Otro grupo de enfermedades en las que puede estar involucrado el mal funcionamiento de las enzimas es el cáncer. Además de muchas otras funciones, las enzimas también son responsables de regular la división celular, las llamadas tirosina quinasas. Si estas enzimas fallan en esta área, puede ocurrir una división celular descontrolada y por lo tanto un proceso neoplásico.
- Enfisema
Una enfermedad menos común es el enfisema, en cuyo caso la elastasa se vuelve hiperactiva. Es una enzima presente en el tejido pulmonar responsable de la degradación de la proteína elastina presente en los pulmones, entre otras.
Si es demasiado activo, el equilibrio entre la destrucción y la construcción se altera, se forman cicatrices y se desarrolla enfisema.
Enzimas: uso en diagnóstico.
El diagnóstico médico moderno se basa en el uso de enzimas en sus determinaciones. Esto se debe al hecho de que los estados patológicos conducen directa o indirectamente a un desequilibrio de las enzimas, provocando aumentos o disminuciones en su cantidad en sangre.
Esto puede deberse no solo a trastornos de producción, sino también, por ejemplo, a la liberación de una gran cantidad de enzima intracelular en la sangre u orina como resultado del daño a su membrana celular.
Ejemplos de enzimas utilizadas en pruebas de laboratorio son:
- Creatina quinasa: una enzima presente en los músculos, también en el músculo cardíaco, su aumento múltiple puede indicar un ataque cardíaco, miocarditis, enfermedades musculares, lesiones, distrofia.
- Lactato deshidrogenasa: presente en todas las células del cuerpo, especialmente en el cerebro, los pulmones, los glóbulos blancos y los músculos. Su gran aumento se observa en infartos, enfermedades musculares y hepáticas o cáncer.
- La fosfatasa alcalina se encuentra principalmente en el hígado y los huesos, aquí es liberada por los osteoblastos. Las enfermedades de estos órganos pueden causar su crecimiento, pero el exceso de fosfatasa alcalina también puede indicar el proceso de regeneración de los huesos, después de una cirugía o fractura.
- La fosfatasa ácida se produce en muchos órganos: hígado, riñones, huesos, próstata, desde el punto de vista del diagnóstico, su aumento puede indicar enfermedades de los huesos y la próstata.
- Aspartato aminotransferasa y alanina aminotransferasa: estas son enzimas características del hígado, que se encuentran casi exclusivamente en los hepatocitos, se utilizan en el diagnóstico de detección básico de enfermedades hepáticas y sus valores de varias veces siempre conducen a un diagnóstico adicional de enfermedades hepáticas.
- Glutamato deshidrogenasa y gammaglutamiltransferasa: otras enzimas hepáticas, al igual que las mencionadas anteriormente, son importantes en el diagnóstico de enfermedades de este órgano y tracto biliar.
- La amilasa es una enzima presente en muchos órganos, pero la mayor concentración se logra en las células del páncreas y glándulas salivales, su diagnóstico es de suma importancia en sus enfermedades.
- La lipasa es otra enzima pancreática, difiere en especificidad de la amilasa, lo que significa que la lipasa está presente solo en el páncreas y las desviaciones de la norma en la determinación de esta enzima indican enfermedad pancreática.
- La colinesterasa es una enzima que descompone la acetilcolina, un transmisor en el sistema nervioso, donde también está presente en la mayor cantidad, en el diagnóstico se usa en intoxicaciones con compuestos organofosforados.
- Factores de coagulación y fibrinólisis: son sustancias producidas por el hígado involucradas en la coagulación de la sangre, sus determinaciones son importantes no solo en la evaluación de este proceso, sino también en el monitoreo de la función hepática.
- Alfa-fetoproteína: una enzima hepática, cuya cantidad aumenta en las enfermedades de este órgano, incluido el cáncer.
- Proteína C reactiva: producida por el hígado, que participa en la respuesta inmune, su cantidad aumenta en la sangre en afecciones inflamatorias: infecciones, lesiones, enfermedades autoinmunes.
- Ceruloplasmina: otra enzima hepática, cuyo aumento es característico de la enfermedad de Wilson.
- La piridinolina y la desoxipiridinolina son marcadores de resorción (destrucción) ósea y caracterizan la función de los osteoclastos (células osteogénicas).
- Mioglobina: como se mencionó anteriormente, es un compuesto característico de los músculos, por lo que su aumento indicará daño a los músculos esqueléticos o cardíacos.
- Las troponinas, los llamados marcadores de ataque cardíaco, son enzimas que regulan la contracción de las fibras musculares, son especialmente abundantes en el músculo cardíaco. Su daño provoca la liberación de grandes cantidades de troponinas a la sangre, que se utiliza en el diagnóstico de enfermedades cardíacas. Sin embargo, vale la pena recordar que un aumento de troponinas puede indicar no solo un ataque cardíaco, sino también su insuficiencia, defectos valvulares o embolia pulmonar.
Todas las enzimas enumeradas anteriormente se pueden clasificar en varios grupos:
- Enzimas secretoras: el límite inferior de la norma es diagnóstico. Estas son enzimas que son producidas fisiológicamente por órganos, pero en el caso de enfermedades su número disminuye, por ejemplo, factores de coagulación.
- Enzimas indicadoras: el crecimiento es importante. Este grupo de enzimas aparece en grandes cantidades debido al daño orgánico y la pérdida de enzimas, entre ellas, por ejemplo, troponinas.
- Enzimas excretoras: son enzimas que se producen normalmente en la luz de varios órganos: la boca, los intestinos y el tracto urinario. Si su salida está bloqueada, entran en la sangre, por ejemplo, amilasa.
Vale la pena recordar que las enzimas se utilizan en el diagnóstico médico en sí. Los análisis bioquímicos se realizan con el uso de enzimas, y la interpretación adecuada de los resultados de las reacciones enzimáticas permite proporcionar el resultado de una prueba de laboratorio.
Enzimas y tratamiento
Muchos fármacos actúan influyendo en la acción de las enzimas, ya sea haciéndolas actuar o, por el contrario, siendo inhibidores. Hay sustitutos de enzimas como la pancreatina que contienen lipasa y amilasa para la insuficiencia pancreática.
Por otro lado, algunos grupos de fármacos inhiben la acción de las enzimas, por ejemplo, los inhibidores de la enzima convertidora de angiotensina, utilizados, entre otros, en la hipertensión y la insuficiencia cardíaca, o algunos antibióticos, por ejemplo, la amoxicilina, que inhibe la enzima transpeptidasa bacteriana, que impide la formación de la pared celular bacteriana, y por tanto inhibe infección.
Algunos venenos también actúan al afectar las enzimas. El cianuro es un potente inhibidor de la citocromo oxidasa, un componente esencial de la cadena respiratoria. Bloquearlo evita que la célula obtenga energía, lo que conduce a su muerte.
Para el correcto curso de los procesos de vida de las células, es necesaria la presencia de muchas sustancias químicas, que permanecen en proporciones estrictas entre sí, y entre las cuales ocurren constantemente reacciones químicas.
Esta tarea es realizada por enzimas que funcionan correctamente, que son necesarias para que casi cualquier reacción química tenga lugar con la velocidad y eficiencia necesarias para el correcto funcionamiento del cuerpo humano.
La acción de las enzimas acelera estos procesos muchas veces, a menudo incluso cientos de veces, lo cual es importante, las enzimas en sí mismas no se desgastan durante las reacciones que tienen lugar.
La falta de catalizadores o su funcionamiento inadecuado puede resultar en la aparición de muchas enfermedades. Por otro lado, la modificación hábil de su actividad le permite tratar con éxito muchas dolencias.
La enzimología (la ciencia de las enzimas) es extremadamente extensa, y su desarrollo puede traer no solo avances científicos, sino también contribuir activamente al desarrollo de la medicina en términos no solo de tratamiento, sino también de diagnóstico.
Sobre el Autor


.jpg)









-przyczyny.jpg)