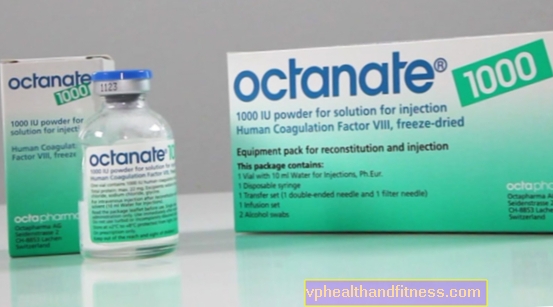
1 vial contiene nominalmente 250 UI, 500 UI o 1000 UI factor VIII de coagulación humano. Este medicamento contiene sodio (menos de 1 mmol (23 mg) / vial 250 UI, hasta 1,75 mmol (40 mg) / vial 500 UI y hasta 1,75 mmol (40 mg) / vial 1000 UI).
| Nombre | Contenido del paquete | La sustancia activa | Precio 100% | Última modificación |
| Octanate | 1 vial 1000 UI + disolver, pulverizar y disolver para preparar solución por shock y / o inf. | Factor VIII | 2019-04-05 |
Acción
Medicamento antihemorrágico, factor VIII de coagulación sanguínea. El factor VIII de coagulación existe como un complejo bimolecular con el factor von Willebrand (FVIII y vWF), que tiene diferentes funciones fisiológicas. Cuando se administra a pacientes con hemofilia, el factor VIII se une al factor von Willebrand en el torrente sanguíneo del paciente. El factor VIII activo actúa como cofactor del factor IX activo, acelerando la conversión del factor X en factor X activo. El factor X activo convierte la protrombina en trombina. La trombina luego convierte el fibrinógeno en fibrina, lo que permite que se forme un coágulo. Después de inyectar la preparación, aproximadamente 2/3 a 3/4 del factor VIII permanece en la circulación. El nivel de actividad del factor VIII alcanzado en plasma debe estar entre el 80% y el 120% de la actividad prevista del factor VIII. La actividad del factor VIII en plasma disminuye en una distribución exponencial de dos fases. En la fase inicial, la distribución entre los compartimentos intravasculares y otros (líquidos corporales) tiene una vida media de eliminación plasmática de 3 a 6 h. En la siguiente fase, más lenta, que probablemente refleje el consumo de factor VIII T0.5, de 8 a 20 h .
Dosis
Por vía intravenosa, no administrar más de 2-3 ml / min. La dosis y la duración de la terapia de sustitución dependen de la gravedad de la deficiencia de factor VIII, el sitio y la extensión del sangrado y el estado clínico del paciente. El número de unidades de factor VIII administradas se expresa en Unidades Internacionales (UI), que es el estándar actual para las preparaciones de factor VIII aprobadas por la OMS. La actividad del factor VIII en plasma se expresa como un porcentaje (relativo al plasma humano normal) o en UI. de acuerdo con el estándar internacional para el factor VIII en plasma. 1 UI La actividad del factor VIII es equivalente a la cantidad de factor VIII en 1 ml de plasma humano normal. El cálculo de la dosis requerida de factor VIII se basa en los datos empíricos de que 1 UI factor VIII / kg aumenta la actividad plasmática del factor VIII en un 1,5-2% de la actividad normal. La dosis requerida se determina usando la siguiente fórmula: número requerido de unidades = mes. (kg) x aumento requerido del factor VIII (%) (UI / dL) x 0,5. La cantidad y la frecuencia de administración deben ajustarse individualmente. Sangrado temprano en articulaciones, músculos o boca: el nivel requerido de factor VIII es 20-40% de lo normal, la infusión debe repetirse cada 12-24 horas, durante al menos 1 día, hasta que el dolor causado por el sangrado haya desaparecido o la herida haya cicatrizado. Sangrado más extenso en las articulaciones, músculos o hematoma: 30-60% de lo normal, repita las infusiones cada 12-24 horas durante 3-4 días o más, hasta que el alivio del dolor y la función regresen. Sangrado potencialmente mortal: 60-100% de lo normal, repita las infusiones cada 8-24 horas hasta que se resuelva la amenaza. Cirugía menor, incluida la extracción de dientes: 30-60% de la norma cada 24 horas, al menos 1 día, hasta que cicatrice la herida. Cirugía mayor: 80-100% de lo normal (antes y después de la cirugía), repita las infusiones cada 8-24 horas hasta que la herida cicatrice adecuadamente, luego continúe la terapia durante al menos 7 días consecutivos para mantener la actividad del factor VIII a 30 -60%. Infusión continua: el aclaramiento estimado debe calcularse antes de la cirugía. La velocidad de infusión inicial se puede calcular de la siguiente manera: aclaramiento x concentración en estado estable deseada = velocidad de infusión (UI / kg / h). Después de las primeras 24 horas de infusión continua, el aclaramiento se debe volver a calcular cada día utilizando una fórmula de estado sólido con la concentración medida y la velocidad de infusión conocida. Es necesaria una determinación regular de los niveles plasmáticos de factor VIII para calcular la dosis y determinar la frecuencia de las perfusiones. Para la profilaxis a largo plazo de la hemorragia en pacientes con hemofilia A grave, se debe administrar una dosis de factor VIII de 20 a 40 UI. factor VIII / kg a intervalos de 2-3 días.
Indicaciones
Tratamiento y profilaxis de hemorragias en pacientes con hemofilia A (deficiencia congénita de factor VIII). El medicamento no contiene una cantidad farmacológicamente eficaz de factor von Willebrand y, por lo tanto, no se puede utilizar en el tratamiento de la enfermedad de von Willebrand.
Contraindicaciones
Hipersensibilidad al principio activo o cualquiera de los ingredientes.
Precauciones
Si se presentan síntomas de hipersensibilidad, suspenda el uso de la preparación inmediatamente. Los métodos estándar para prevenir infecciones causadas por preparaciones de plasma o sangre humana incluyen la selección de donantes, la prueba de donaciones individuales y mezclas de plasma para marcadores específicos de infección y el uso de métodos de fabricación eficaces para inactivar / eliminar virus. A pesar de ello, cuando se administran medicamentos preparados a partir de sangre o plasma humanos, no se puede excluir totalmente la posibilidad de transmisión de agentes infecciosos. Esto también se aplica a virus desconocidos o emergentes y otros patógenos. Los métodos utilizados se consideran eficaces contra virus envueltos como el VIH, VHB y VHC, y pueden tener un valor limitado contra virus no envueltos como el VHA y el parvovirus B19 (pueden ser peligrosos para mujeres embarazadas y para pacientes con inmunodeficiencia o eritropoyesis excesiva). Las vacunas adecuadas (contra la hepatitis A y B) están indicadas en pacientes que reciben tratamiento regular o repetido con factor VIII de coagulación humano. El desarrollo de anticuerpos neutralizantes del factor VIII (inhibidores) es una complicación conocida cuando se trata a pacientes con hemofilia A; se debe controlar a los pacientes para detectar el desarrollo de anticuerpos inhibidores mediante observaciones clínicas y pruebas de laboratorio adecuadas. Ha habido informes en la literatura que muestran una correlación entre la aparición de inhibidores del factor VIII y reacciones alérgicas. Los pacientes que experimentan reacciones alérgicas deben someterse a pruebas de detección del inhibidor debido al aumento del riesgo de anafilaxia inducida por factor VIII. Debido al riesgo de reacciones alérgicas, la primera administración de factor VIII debe realizarse, a criterio del médico tratante, bajo supervisión médica en un lugar donde se pueda proporcionar la asistencia médica adecuada en caso de una reacción alérgica. El medicamento contiene sodio - 1 vial de 250 UI Contiene menos de 1 mmol (23 mg) de sodio, es decir, esta dosis es esencialmente 'libre de sodio' y 1 vial de 500 UI. o 1000 UI Contiene hasta 1,75 mmol (40 mg) de sodio, lo que debe tenerse en cuenta en pacientes con una dieta restringida en sodio.
Actividad indeseable
Raras: reacciones de hipersensibilidad, fiebre, anticuerpos anti-factor VIII presentes en la sangre. Muy raro: shock anafiláctico.
Embarazo y lactancia
Debido a la rara aparición de hemofilia A en mujeres, no se dispone de experiencia sobre el uso del factor VIII durante el embarazo y la lactancia. Por lo tanto, el factor VIII durante el embarazo y la lactancia solo debe administrarse cuando esté estrictamente indicado.
Interacciones
No se conocen interacciones de las preparaciones de factor VIII de coagulación humano con otros fármacos.
La preparación contiene la sustancia: Factor VIII
Medicamento reembolsado: NO